【化学結合と融点・沸点の関係】結合の強さでわかる!覚えるべきポイントと例を徹底解説!

こんにちは!櫻學舎講師の菊池涼です。
今回は、化学結合の種類と融点・沸点の関係性について、テストでよく出るポイントをまとめながら、初心者でも理解できるように丁寧に解説していきます。
キーワードは「結合が強いほど融点・沸点が高い」!
この記事を読み終える頃には、化学結合と状態変化(固体⇔液体⇔気体)の関係がすっきり理解できるはずです。
化学結合の種類と強さの順番
化学結合には大きく分けて以下の2つのカテゴリがあります。
- 化学結合(イオン結合・共有結合・金属結合)
- 分子間力(水素結合・ファンデルワールス力)
そして、これらの結合を強さの順で並べると以下のようになります。
共有結合 > イオン結合 > 金属結合 > 水素結合 >>> ファンデルワールス力
共有結合は電子を共有することで原子を強く結びつけるため、最も強固な結合です。一方、ファンデルワールス力は分子同士に働く非常に弱い力です。
融点・沸点とは? そして熱運動との関係
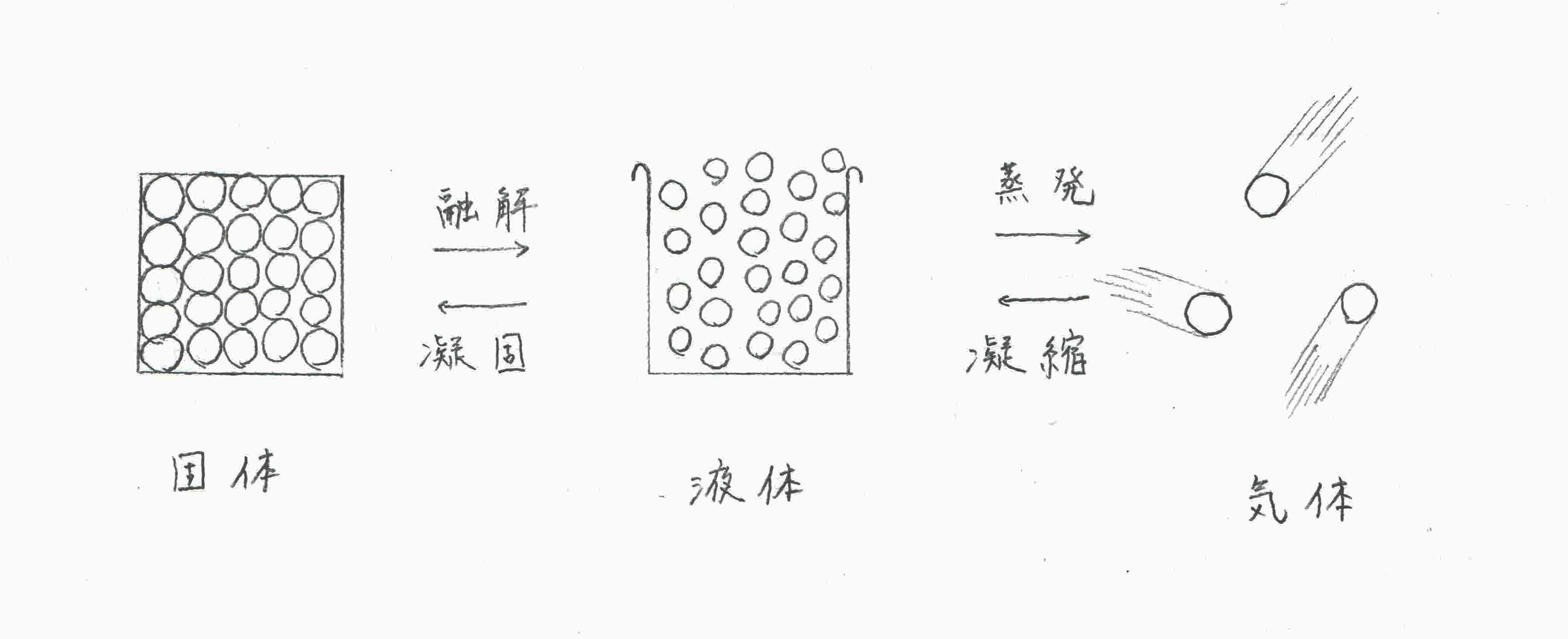
- 融点…固体が液体になる温度
- 沸点…液体が気体になる温度
物質が状態変化するには、分子の間に働く結合を切るだけのエネルギー(熱運動)が必要です。
- 固体:分子は規則的に並び、ほとんど動かない(分子間力が強く働いている)
- 液体:分子は移動可能だが、まだ結合あり
- 気体:分子間の結合はほぼゼロ
つまり、強い結合ほど多くのエネルギー(高い温度)が必要=融点・沸点が高くなるということです。
分子間力と融点・沸点の関係
- 無極性分子の場合
→分子量が大きいほどファンデルワールス力も強くなり、融点・沸点も上がる - 極性分子の場合
→静電気的な引力が強く働くため、無極性分子より融点・沸点が高くなる
ここでもキーワードは「結合が強いほど融点・沸点が高い」です!
4水素結合はなぜ沸点が高いのか?
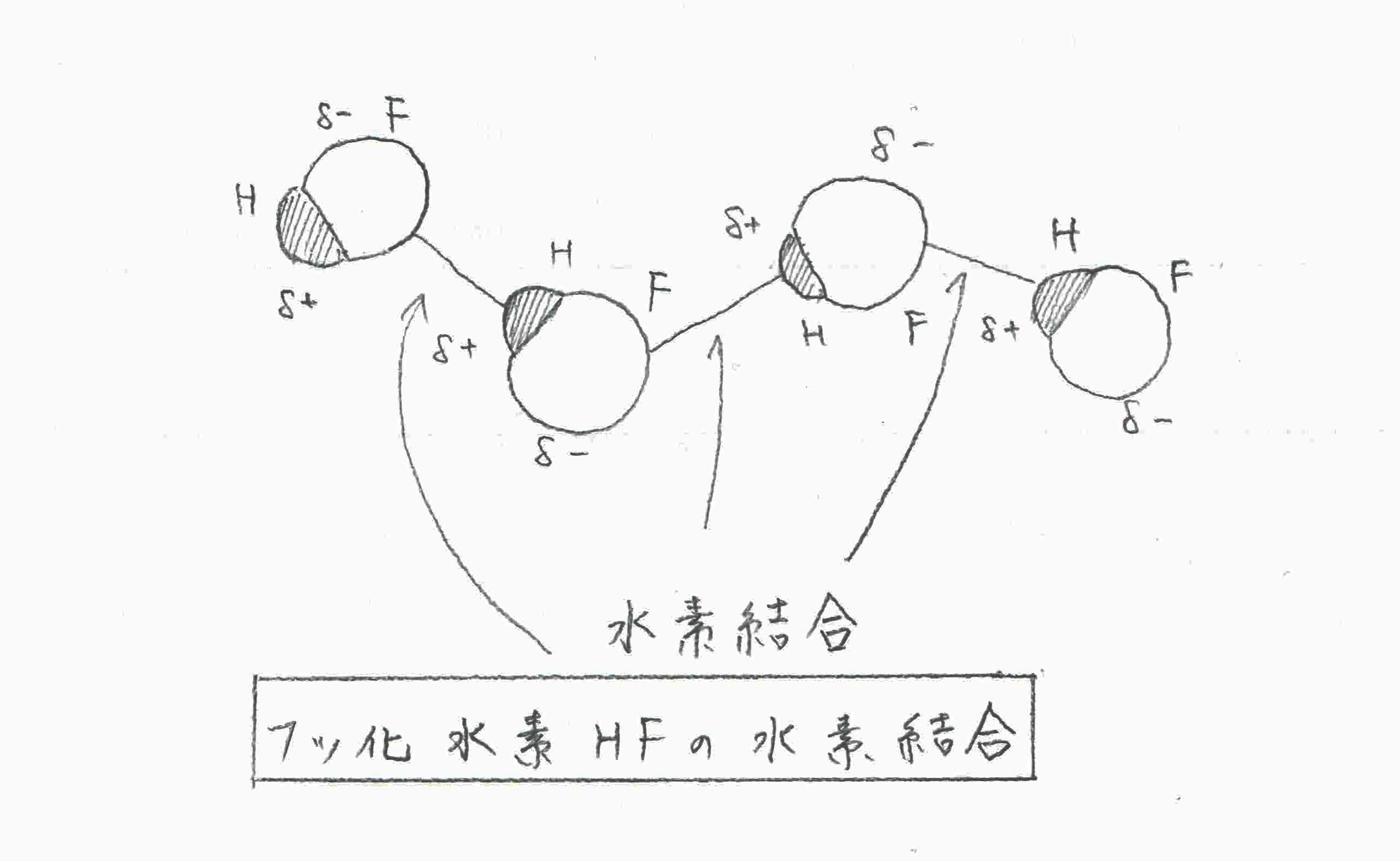
水素結合とは?
H(正の電荷を帯びた水素原子)と、F・O・Nなどの電気陰性度の高い原子が作る特殊な結合です。
水素結合は分子間力の中ではかなり強いため、分子量が小さくても沸点が異様に高くなることがあります。
試験頻出の水素化合物
- HF(フッ化水素)
- H₂O(水)
- NH₃(アンモニア)
これらは、分子量の割に非常に高い沸点を持ち、入試にも頻出です!
結合の種類別|融点・沸点の強さ比較
物質の融点・沸点の高さには、「どのような結合で原子や分子がつながっているか」が大きく関係しています。以下に主な結合の種類と、それぞれの融点・沸点の傾向、特徴をまとめます。
共有結合(共有結合結晶)
共有結合は、原子同士が電子を共有して結びついている結合です。結合力が非常に強く、次のような特徴があります。
- 融点・沸点:非常に高い
- 特徴
- 電子を共有することで、安定した構造を形成。
- ダイヤモンドやケイ素(Si)などが代表例。
- 非常に硬く、溶けにくい。
イオン結合
イオン結合は、陽イオンと陰イオンの間の静電気的な引力によって形成される結合です。
- 融点・沸点:高い
- 特徴
- NaCl(塩化ナトリウム)などの塩類が典型例。
- 固体では硬くてもろいが、水に溶けやすいものが多い。
- 結晶構造が規則正しく並び、強い引力で結びついている。
金属結合
金属結合は、正の金属イオンと自由電子の間の引力によって成り立つ結合です。
- 融点・沸点:やや高い(結合の種類によって幅がある)
- 特徴
- 自由電子の「電子の海」により、電気伝導性・熱伝導性が高い。
- 展性・延性にも優れる。
- 鉄や銅、金など多くの金属元素に見られる。
水素結合
水素結合は、水素原子がF(フッ素)、O(酸素)、N(窒素)などの電気陰性度の高い原子と結合するときに生じる、分子間の弱い結合です。
- 融点・沸点:中程度
- 特徴
- H₂O(氷や水)やNH₃(アンモニア)などに見られる。
- 分子間力としては強めで、液体水の常温存在などにも関係。
- 分子の並び方や形にも影響を与える。
ファンデルワールス力(分子間力)
ファンデルワールス力は、一時的な分極や誘導によって生じる弱い引力です。
- 融点・沸点:低い
- 特徴
- 無極性分子(例:H₂、O₂、CH₄など)に多く見られる。
- 常温で気体や液体の状態で存在することが多い。
- 分子量が大きくなるとファンデルワールス力も大きくなる。
このように、物質の融点・沸点の高さは、結合の種類に強く依存しています。結合が強いほど、原子や分子を引き離すのに必要なエネルギーが大きくなるため、融点や沸点も高くなるのです。
まとめ
高校化学の定期テストや大学入試でも頻出のテーマ「化学結合と融点・沸点」。
以下のポイントを押さえておきましょう。
- 状態変化に必要なのは結合を切るエネルギー
- 結合が強ければそれだけ高温で変化する=融点・沸点が高い
- 「水素結合」や「極性分子」は分子間力が強く、例外的に沸点が高いことも
センター試験・共通テスト対策にもバッチリの内容です!
「なんとなく」覚えるのではなく、「なぜその融点・沸点になるのか?」という結合の強さに注目した理解を意識してみてくださいね。








